31 Marzo de 2021 10:18
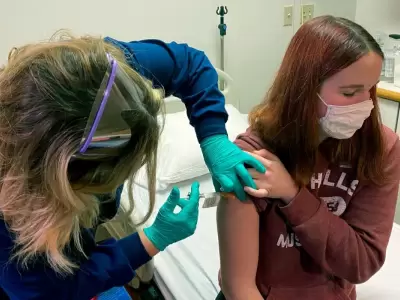
Según anunciaron hoy en un comunicado oficial ambas compañías, la vacuna desarrollada por Pfizer y BioNTech contra el coronavirus tuvo una eficacia del 100% y respuestas sólidas de anticuerpos, además de ser segura, en un ensayo clínico de fase 3 realizado sobre 2.260 participantes de entre 12 y 15 años.
En el estudio, que reclutó a adolescentes de Estados Unidos, se observaron 18 casos de Covid-19 en el grupo de placebo y ninguno en el grupo vacunado.
Además, la vacunación generó una "fuerte inmunogenicidad un mes después de la segunda dosis" y fue bien tolerada por los participantes. De hecho, tanto la respuesta de anticuerpos como la seguridad tuvieron resultados similares con los observados en participantes de 16 a 25 años.
Leer más | Covid-19: Larreta espera tener más detalles sobre el aumento de casos antes de tomar nuevas medidas
Con estas nuevas informaciones, las compañías anunciaron que se presentarán ante los organismos de regulación de Estados Unidos y Europa (FDA y EMA respectivamente) para solicitar una enmienda en la autorización de uso de emergencia que permita expandir su uso en adolescentes de 12 a 15 años.
"Todos los participantes del ensayo continuarán siendo monitoreados para la protección y seguridad a largo plazo durante dos años adicionales después de su segunda dosis", informaron las empresas, que también indicaron que los estudios serán enviados para publicar en una revista científica con revisión de pares.
La semana pasada, Pfizer y BioNTech comenzaron un estudio clínico en niños sanos de 6 meses a 11 años para evaluar la seguridad, tolerabilidad e inmunogenicidad de su vacuna en un programa de dos dosis (aproximadamente con 21 días de diferencia) en tres grupos de edad: niños de 5 a 11 años, de 2 a 5 años y 6 meses a 2 años.

"La cohorte de 5 a 11 años comenzó a administrarse la semana pasada y las empresas planean iniciar la cohorte de 2 a 5 años la próxima semana", añadieron.








